2020年7月14日,《Journal of Cell Biology》学术期刊在线发表了威尼斯欢乐娱人城AⅤ大中国杨崇林教授实验室题为“CDK4/6 regulate lysosome biogenesis through TFEB/TFE3” 的研究论文。本研究发现CDK4/6调控TFEB/TFE3依赖的溶酶体发生,揭示了细胞周期中溶酶体发生的调控机制。
溶酶体是细胞内物质降解的主要场所,同时是调控细胞能量代谢和信号转导的重要场所,其生物学发生和功能受到多种信号的调节。完整的细胞周期包括G1,S,G2,和M四个时期,在这一过程中,细胞的遗传物质复制均等地分配到两个子细胞中。然而,溶酶体是如何在母细胞中增多并分配到子细胞中,这一重要的科学问题目前仍不清楚。
CDK4/6是调控细胞G1期到S期转变的关键因子,它们在细胞质中合成后转移到细胞核内与Cyclin D一起发挥作用。TFEB和TFE3是两个调控溶酶体发生的转录因子,其活性受到多维度调控,它们不断穿梭于细胞质和细胞核之间,维持细胞内溶酶体的稳态。那么在细胞周期中,其活性受到怎样的调控?本研究结合细胞分子影像、生化及流式细胞术等多种技术手段,发现CDK4/6功能缺失诱导TFEB/TFE3依赖的溶酶体发生。细胞核内CDK4/6及Cyclin D1/D3结合并直接磷酸化TFEB/TFE3的丝氨酸位点,从而使TFEB/TFE3失活,从细胞核中转运到细胞质。当细胞从G1期进入S期,Cyclin D1的快速降解导致CDK4/6失活,不能发挥磷酸化TFEB/TFE3的功能,导致大量的TFEB/TFE3驻留在细胞核内,调控S,G2,及M期溶酶体的发生(图1)。
CDK4/6抑制剂LY2835219目前用于癌症治疗的临床试验,该研究发现LY2835219的处理能够提高溶酶体的降解功能,增强细胞自噬,有效的促进亨廷顿病细胞模型中多聚谷氨酰胺(polyQ)的降解,同时也显著促进HepG2细胞中脂滴的降解。这一发现能为癌症及许多溶酶体相关疾病的治疗提供借鉴和参考。
该工作主要由威尼斯欢乐娱人城AⅤ大中国生命科学研究中心杨崇林教授实验室完成。尹秋媛助理研究员和蹇友理副研究员为本研究的共同第一作者。中国科学院遗传与发育生物学研究所和中国科学院昆明动物研究所参与了部分研究。本研究得到国家自然科学基金委及科技部经费的资助。此外,生命科学研究中心流式分选平台为本研究提供了支持。
文章链接:https://rupress.org/jcb/article/219/8/e201911036/151944/CDK4-6-regulate-lysosome-biogenesis-through-TFEB
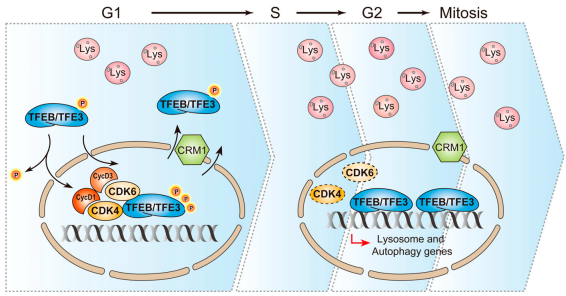
图1 CDK4/6调控细胞周期过程中TFEB/TFE3依赖的溶酶体发生
 微信公众号
微信公众号