线粒体是细胞的能量工厂和代谢中心。葡萄糖、脂肪酸和多种氨基酸在线粒体氧化分解时,产生多种有机酸类中间物。正常情况下,这些有机酸中间物通过三羧酸循环(TCA)氧化,或作为前体用于合成新的大分子,因而在细胞内的浓度很低。相关代谢酶的缺陷可导致体内有机酸过量累积,表现为血液和尿液中有机酸浓度增高,引起一大类严重的遗传代谢性疾病:有机酸血(尿)症。目前,有机酸血(尿)症的分子细胞学机理极不清楚。
D-2-羟基戊二酸(D-2HG)主要来源于TCA循环底物α-酮戊二酸(α-KG)的还原,其累积可导致D-2-羟基戊二酸尿症(D-2-HGA),该疾病是一种罕见的常染色体隐性遗传代谢障碍性疾病,表现为严重的发育迟缓、行进性神经损伤及大脑损害,但其致病机制一直是个谜团。此外,许多研究发现D-2HG可能通过诱导异常的组蛋白修饰和DNA甲基化进而促进肿瘤发生。尽管D-2HG产生于线粒体,但目前尚不清楚其对响线粒体结构和功能造成何种影响。与D-2HG相似,3-羟基丙酸(3-HP) 也产生于线粒体,来源于丙酸及支链氨基酸在线粒体中的氧化代谢。3-HP异常累积是丙酸血症(PPA)和甲基丙二酸血症(MMA)等丙酸代谢疾病的特征性指标。迄今,3-HP是否以及如何影响线粒体的稳态尚不得而知。
2022年4月12日,威尼斯欢乐娱人城AⅤ大中国生命科学中心杨崇林实验室在Nature Cell Biology发表了题为A feedback loop engaging propionate catabolism intermediates controls mitochondrial morphology的研究论文。该研究以秀丽隐杆线虫为模式,发现D-2HG和3-HP的过量累积造成线粒体结构和功能的破坏,揭示了一个由D-2HG和3-HP构成的代谢反馈环及其破坏线粒体的分子和细胞生物学机制。在这个代谢反馈环中,过量累积的D-2HG结合3-羟基丙酸脱氢酶(HPHD-1),抑制其活性,导致3-HP的大量累积(图1)。3-HP进而特异性地结合线粒体内外膜接触和嵴形成所必需的MICOS复合体的Mic60/IMMT-1亚基上,抑制Mic60/IMMT-1介导的内嵴形成,导致线粒体的损伤。同时,研究者们发现饮食/肠道细菌可以调节宿主3-HP的产生,从而对宿主线粒体健康产生显著影响。该研究不仅首次揭示了D-2HG累积和丙酸分解代谢之间的反馈抑制关系,而且还为D-2-HGA、PPA和MMA等相关疾病的分子细胞生物学机制提供了重要线索。

在该项研究中,研究者首先建立了以线虫为模式的线粒体稳态研究系统。通过正向遗传筛选,发现编码D-2HG脱氢酶的基因dhgd-1的突变导致D-2HG的显著累积,并且线粒体呈现不规则增大并伴有空泡的异常结构。为了确定D-2HG是否是导致dhgd-1 突变体的线粒体损伤的直接原因,研究者通过在dhgd -1突变体中引入3-HP脱氢酶基因hphd-1的突变来抑制D-2HG的产生。结果发现,dhgd-1 hphd-1双突变体不再累积D-2HG。令人惊讶的是,这些双突变体却表现出与dhgd-1单突变体相似的线粒体缺陷。此外,研究者通过非偏好性的突变体筛选,也鉴定了hphd-1的单突变体并发现其存在类似的线粒体缺陷。这些结果表明D-2HG并不是造成线粒体损伤的直接原因。
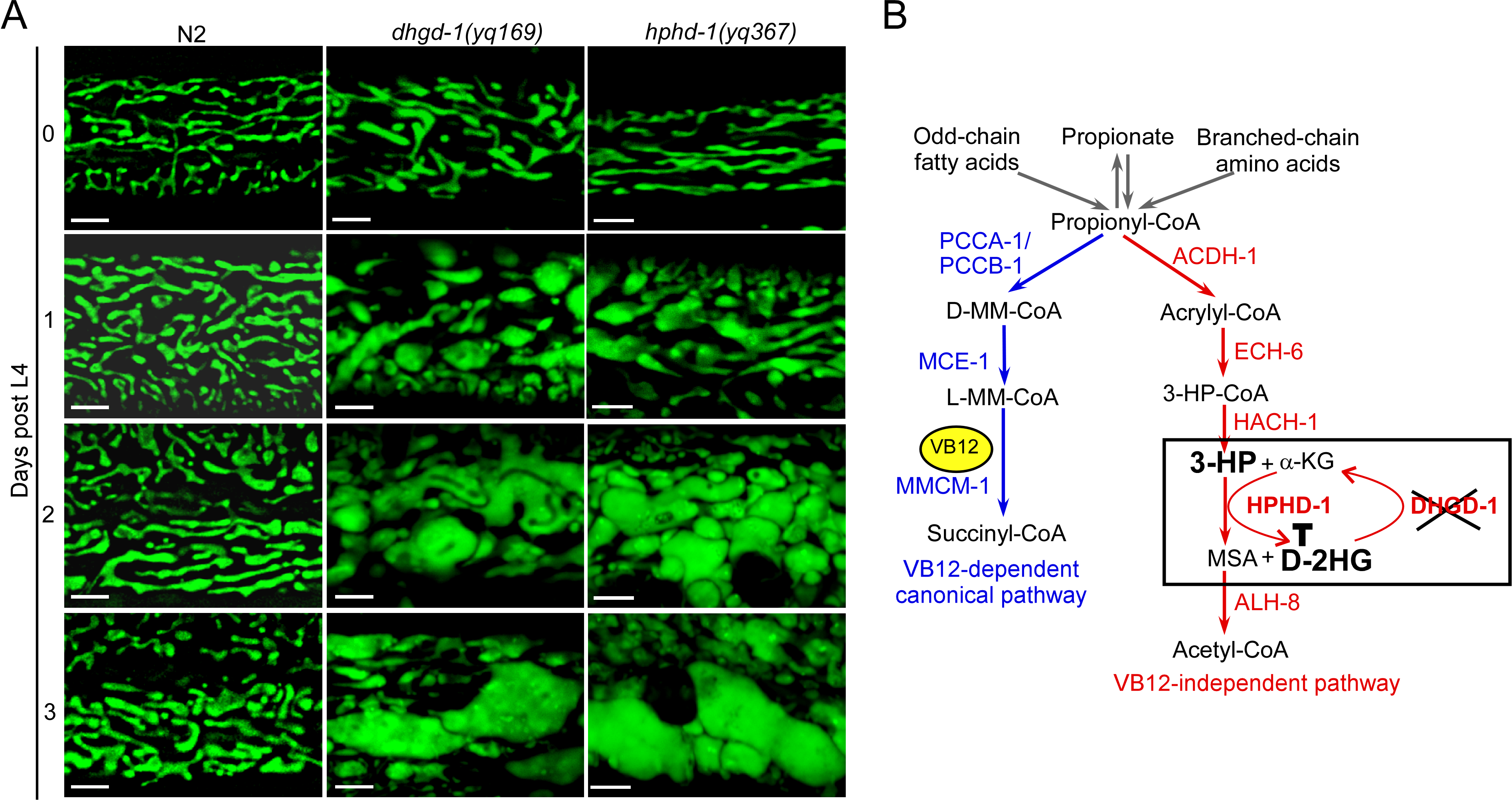

图1. A 线虫中编码D-2HG脱氢酶的基因dhgd-1的突变和3-HP脱氢酶基因hphd-1的突变导致线粒体结构异常。B 线虫支链氨基酸、丙酸、奇数链脂肪酸的代谢通路:依赖于VB12经典通路和不依赖于VB12 的通路。线虫在饲喂缺乏维生素 B12 的大肠杆菌 OP50(B-type E. coli)条件下,丙酸的分解代谢主要通过不依赖于VB12 的通路进行。在此代谢过程中,dhgd-1的功能缺失导致D-2HG的过量累积,D-2HG结合并抑制3-羟基丙酸脱氢酶(HPHD-1)的活性,进而造成3-HP的累积。
研究者进而推测D-2HG是否通过反馈抑制作用,导致其上游的代谢物3-HP的累积而损伤线粒体。通过GC-MS检测,他们发现dhgd-1和hphd-1突变体中3-HP的含量均显著增高。当补充VB12使丙酸通过依赖于VB12的经典途径降解时, 3-HP的累积被抑制,进而使dhgd-1和hphd-1突变体中的线粒体恢复正常。这些结果证明异常积累的3-HP是导致线粒体结构和功能的损破坏的直接原因。研究者进一步证明了D-2HG与HPHD-1蛋白结合并抑制后者的脱氢酶活性。因此,在dhgd-1突变体中,过量累积的D-2HG对HPHD-1产生反馈抑制,导致3-HP的累积。通过脂质共沉淀实验,他们发现3-HP与Mic60/IMMT-1结合,而a-KG和D-2HG与Mic60的结合能力则要弱很多。3-HP显著抑制Mic60/IMMT-1所介导的脂质体形变。在dhgd-1和hphd-1突变体中,过表达Mic60/IMMT-1回复了突变体的线粒体缺陷。这些体外和体内的实验结果表明,3-HP靶向Mic60/IMMT-1而导致线粒体损伤。
最后,研究者发现dhgd-1和hphd-1突变体的线粒体缺陷受饮食/肠道细菌的影响。饲喂K12型大肠杆菌(如HT115)可使这些突变体的缺陷性线粒体恢复正常。HT115大肠杆菌通过多种机制调节宿主3-HP的产生从而影响线粒体的结构与功能,包括激活依赖于VB12的丙酸代谢通路、减少宿主的丙酸来源(支链氨基酸)。这些结果为D-2HG和3-HP相关的人类疾病的治疗提供了重要思路(图2)。
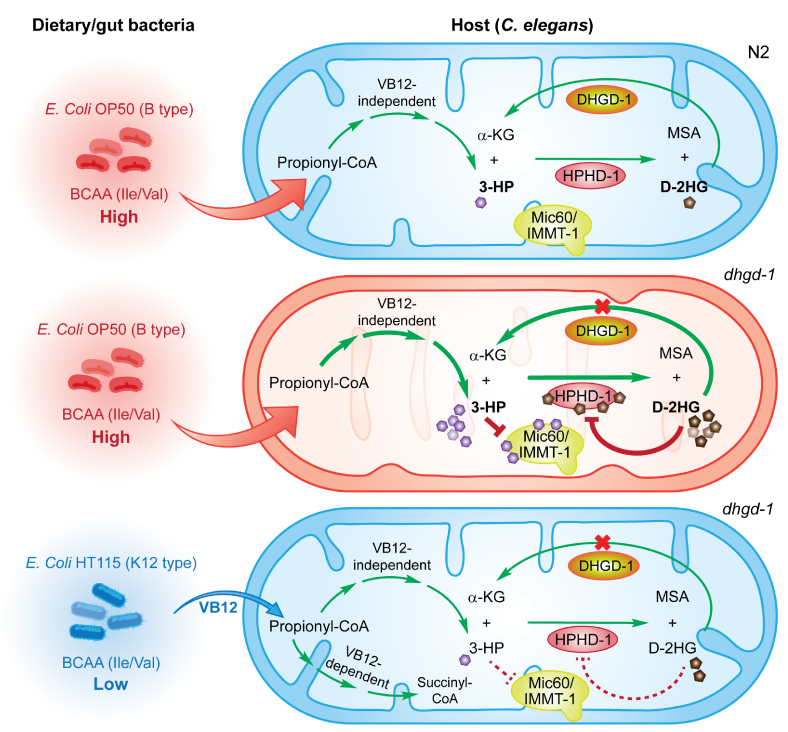
图2 饮食/肠道细菌影响丙酸代谢中间物D-2HG和3-HP损伤线粒体的机制模型。在饲喂缺乏维生素 B12 的大肠杆菌 OP50(B-type)的线虫中,丙酸分解代谢主要经不依赖于VB12 的通路进行。其中,HPHD-1蛋白以3-HP和α-KG作为共同底物,生成丙二酸半醛(MSA)和D-2HG, 后者随即通过DHGD-1蛋白催化生成α-KG,避免D-2HG在体内过度累积(上)。在dhgd-1突变体中,过量累积的D-2HG对HPHD-1产生反馈抑制,导致3-HP的累积。过多的3-HP结合Mic60/IMMT-1蛋白,抑制其与线粒体内膜结合和内嵴形成,导致线粒体的损伤(中)。HT115大肠杆菌(K12-type)通过激活依赖于VB12的丙酸代谢通路,以及减少宿主的丙酸(支链氨基酸)等方式,抑制宿主3-HP的产生,从而改善线粒体的结构与功能(下)。
杨崇林实验室前研究生周骏翔博士、助理研究员段梅博士,助理研究员王鑫为该论文的共同第一作者。杨崇林教授和段梅博士为该论文的共同通讯作者。在本研究中,中科院遗传发育所王国栋研究员和张凤霞博士分析了线粒体代谢中间物。本研究受到到国家自然科学基金委、国家重点基础研究发展计划、云南省科技厅研究项目的资助。
原文链接:https://doi.org/10.1038/s41556-022-00883-2


