点评 | 张宏 研究员(中科院生物物理所)
锌在生物体中以离子(Zn2+)的形式存在,作为生物体必需的微量元素,Zn2+在发育、代谢、DNA合成和转录调控等生理和细胞过程中发挥着重要作用【1,2】。在人体中,Zn2+与10%的总蛋白结合,或作为功能蛋白的结构成分(如锌指),或作为催化酶的辅因子【1,3】。Zn2+缺乏会导致生长发育不良、先天性神经和免疫紊乱、伤口愈合不良、慢性炎症和出血等症状【2,4】。反之,Zn2+过量对细胞也是剧毒的【5】。
线粒体是细胞的代谢中心和能量工厂,三羧酸循环、氧化磷酸化和ATP产生都发生于线粒体中,协同地为细胞生存和功能发挥提供能量。线粒体中的Zn2+参与调节线粒体动态、细胞凋亡及线粒体自噬等过程。Zn2+在线粒体中的异常累积会导致线粒体膜电势丧失、电子传递链复合体I和III功能抑制、高ROS产生以及诱导细胞凋亡等【6】。尽管许多线粒体蛋白活性发挥是Zn2+依赖的,但当线粒体Zn2+稳态破坏时,线粒体结构和功能会受到怎样的影响,其细胞生物学机制仍有待阐明。目前,线粒体中Zn2+稳态由何种Zn2+转运蛋白控制尚不得而知。 2021年10月23日,威尼斯欢乐娱人城AⅤ大中国杨崇林教授研究团队在Protein & Cell上在线发表了题为“A pair of transporters controls mitochondrial Zn2+ levels to maintain mitochondrial homeostasis”的研究论文。该研究利用模式动物秀丽线虫进行正向遗传学筛选,发现一个线粒体定位的Zn2+转运蛋白SLC-30A9/Znt-9,它控制Zn2+由线粒体向细胞质的转运。slc-30A9的功能缺失导致线粒体Zn2+异常积累,破坏线粒体的结构和功能,损害线虫的发育和寿命(图1)。

为进一步揭示Zn2+进入线粒体的调控机制,研究者以线粒体形态和未折叠蛋白应激反应(UPRmt)两种策略对slc-30A9突变体进行抑制因子(suppressor)筛选,获得的5个突变体均导致了同一个Ca2+激活型Mg2+-ATP转运蛋白SLC-25A25/SCaMC-2突变。研究发现,在slc-30A9突变体背景下功能缺失slc-25A25能明显降低线粒体中高水平的Zn2+,并回复线粒体的功能缺陷和线虫发育。同时,在HeLa细胞中异源表达线虫或人类SLC-25A25蛋白,也可以看到线粒体片段化,且线粒体中Zn2+水平显著升高。以上研究结果表明,SLC-25A25介导Zn2+向线粒体的转运。此外,在线虫和HeLa细胞中敲降一个内质网定位的Zn2+转运蛋白SLC-30A5,可以很好地回复slc-30A9突变体中异常增大的线粒体,降低内质网和线粒体中的Zn2+水平,缓解线粒体功能和发育的缺陷。这表明内质网是细胞内的Zn2+库,是线粒体中Zn2+的部分来源。
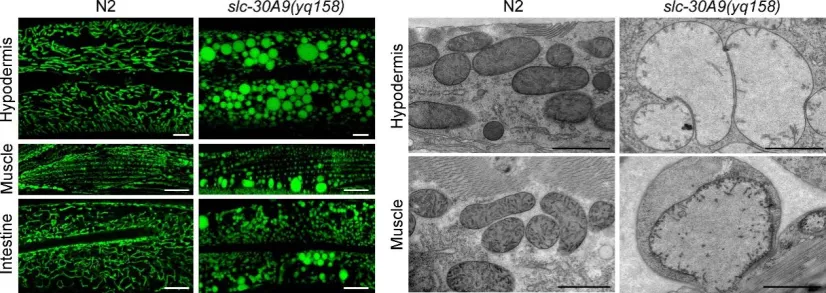
图1. slc-30A9基因的功能缺失突变体slc-30A9(yq158)中表皮、肌肉和肠道等细胞内线粒体破坏。左图:Mito-GFP标记的线粒体;右图:电镜图。N2为野生型。
综上,本研究揭示了一对控制Zn2+进出线粒体的转运蛋白,它们协同作用控制线粒体内的Zn2+水平,进而调控线粒体稳态。该研究不仅揭示了线粒体内Zn2+水平对其结构和功能的重要性,而且为进一步的线粒体Zn2+生物学研究提供了重要基础。
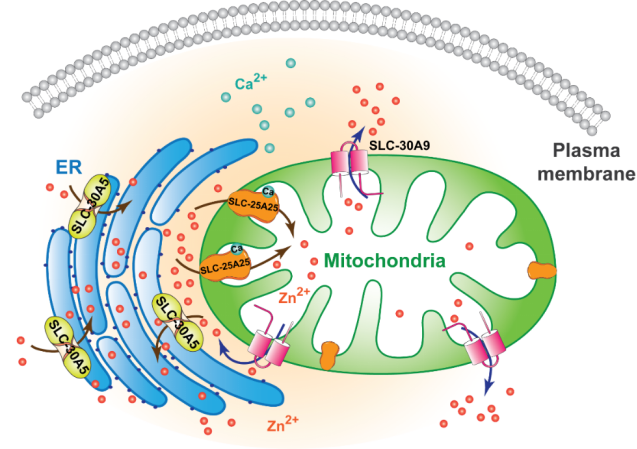
图2 一对锌离子转运蛋白SLC-30A9/SLC-25A25共同调控线粒体稳态的机制示意图
杨崇林研究组的博士生马腾飞、赵丽媛博士、助理研究员张洁博士和汤若风博士为该论文的共同第一作者。杨崇林教授和张洁博士为该论文的共同通讯作者。
原文链接:
https://link.springer.com/article/10.1007/s13238-021-00881-4
专家点评
张宏 研究员(中国科学院生物物理研究所)
20世纪70年代,Sydney Brenner教授的开拓性研究确立了秀丽隐杆线虫(C. elegans)在现代生命科学研究中的重要地位和独特作用。基于秀丽线虫的遗传筛选和生物学机制研究一次次地为我们带来惊喜。在本项工作中,研究者采用多种策略,通过秀丽线虫无偏好性的正向遗传筛选和定向基因筛选,发现了以前未知的定位于线粒体Zn2+转运蛋白,它们分别控制Zn2+在线粒体的进出,使线粒体内的Zn2+处于恰当的水平。该工作突显了秀丽线虫遗传学在发现新基因功能及其作用机制方面的独特优势。
人类SLC30A9蛋白功能缺陷与常染色体隐性脑-肾综合征相关,SLC25A25的表达水平也与I型糖尿病和肝癌发病相关。该研究结果不仅揭示了调节线粒体Zn2+稳态对维持正常线粒体结构和功能的分子和细胞生物学机制,也为认识和治疗Zn2+及线粒体相关的人类疾病提供了理论依据。
参考文献
1. Colvin RA, Holmes WR, Fontaine CP, Maret W (2010) Cytosolic zinc buffering and muffling: their role in intracellular zinc homeostasis. Metallomics 2:306–3172.
2. Kambe T, T suji T, Hashimoto A, Itsumura N (2015) The physiological, biochemical, and molecular roles of zinc transporters in zinc homeostasis and metabolism. Physiol Rev 95:749–7843.
3. Andreini C, Banci L, Bertini I, Rosato A (2006) Counting the zinc-proteins encoded in the human genome. J Proteome Res 5:196–2014.
4. Mammadova-Bach E, Braun A (2019) Zinc homeostasis in platelet-related diseases. Int J Mol Sci 20:52585.
5. Sensi SL, Paoletti P, Bush AI, Sekler I (2009) Zinc in the physiology and pathology of the CNS. Nat Rev Neurosci 10:780–7916.
6. Dineley KE, Votyakova TV, Reynolds IJ (2003) Zinc inhibition of cellular energy production: implications for mitochondria and neurodegeneration. J Neurochem 85:563–570
本文转载自公众号“BioArt”(BioGossip)


